Penjelasan Konfigurasi Elektron Secara Lengkap – Dalam pelajaran kimia terdapat materi mengenai konfigurasi elektron. Elektron melakukan orbit pada tingkatan energi tertentu. Pengorbitan tersebut dinamakan kulit. Kulit elektron ialah beberapa orbital yang mengelompok dengan tingkat energi yang sama. Dalam konfigurasi elektron tersebut juga terdapat sub kulit yaitu beberapa orbital yang mengelompok, namun memiliki label orbital yang sama, dimana nilai n dan l adalah sama. Maka dari itu nilai tiga orbital 2p akan membentuk sebuah sub kulit. Model orbital tadi diciptakan oleh Neils Bohr.
Neils Bohr merupakan orang yang pertama kali memberikan usul perioditas dalam tabel periodik, kemudian dijabarkan dengan struktur elektron atom. Hingga sampai akhirnya dapat membentuk konfigurasi elektron seperti sekarang ini. Lantas bagaimana konsep konfigurasi elektron itu? Pada kesempatan kali ini saya akan menjelaskan mengenai konfigurasi elektron lengkap. Berikut ulasan selengkapnya.
Penjelasan Konfigurasi Elektron Secara Lengkap
Konfigurasi elektron ialah susunan pengisian dan penyebaran elektron bagian dalam. Dalam sebuah atom terdapat molekul subatomik proton dan neutron yang berada di inti atom. Kemudian elektron akan mengelilingi inti atom pada level atau kulit elektron tertentu. Jalur penyebaran elektron tersebut dinakaman kulit elektron. Kulit yang paling dekat dengan inti atom atau kulit pertama dinamakan kulit K. Untuk kulit keduanya bernama kulit L, kulit ketiga bernama kulit M dan seterusnya secara urut dalam alfabet hingga kulit tersebut menjauh dengan inti atom. Kulit kulit elektron juga dapat dijelaskan menggunakan bilangan kuantun utama (n). Untuk kulit K disebut 1, kulit L disebut 2, dan seterusnya.
Baca juga : Materi Isotop, Isobar dan Isoton (Pengertian dan Contoh)
Dalam konfigurasi elektron, nilai n yang semakin besar akan mengakibatkan kulit elektron semakin jauh dari inti atom serta energi elektron akan membesar pada kulit yang terkait. Elektron tersebut akan mengisi bagian kulit pada atom, berawal dari kulit K yang memiliki tingkat energi paling rendah. Kulit elektron hanya dapat di isi oleh beberapa jumlah elektron saja. Jumlah maksimal elektron yang yapat mengisi bagian kulit elektron ke n ialah 2n2. Tetapi untuk jumlah maksimal pada bagian kulit elektron terluar dalam atom ialah 8. Untuk lebih jelasnya dapat anda simak gambar dibawah ini.

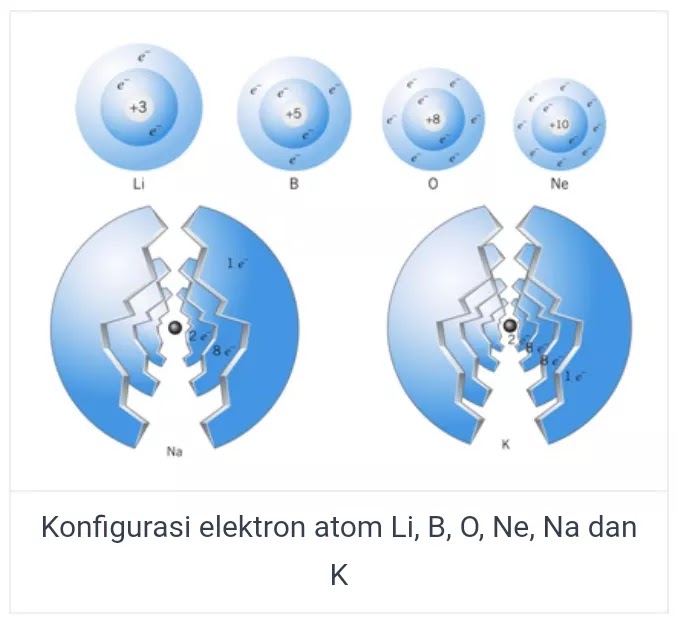
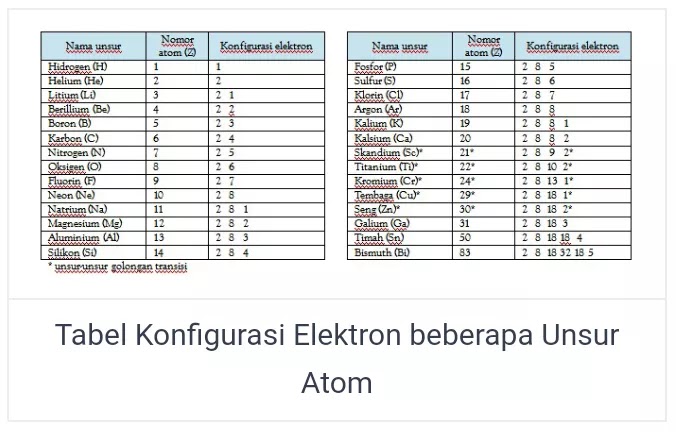
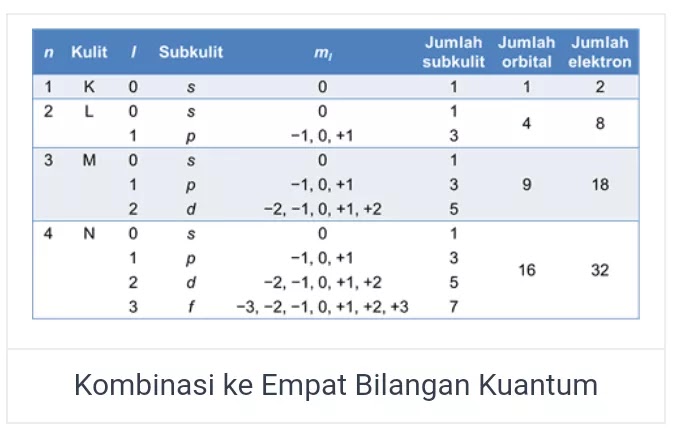
Konfigurasi elektron dalam unsur atom yang transisi, penentuannya tidak menggunakan metode berdasarkan kulit elektron pada atom golongan utama. Penentuan tersebut berdasaran orbital atom. Untuk setiap orbital atom akan dipaparkan melalui satu set bilangan pada kuantum magnetik (m), kuantum utama (n), dan kuantum azimuth (l) yang khusus. Kemudian setiap orbital akan diisi dengan jumlah maksimal 2 elektron yang mempunyai bilangan spin (s). Keempat jenis bilangan kuantum tadi berguna untuk mendiskripsikan energi dalam elektron. Berikut penjelasan selengkapnya :
Baca juga : Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi
- Bilangan kuantun utama (n) dalam konfigurasi elektron menggambarkan tingkat dan ukuran dari energi orbital. Dimana nilai n boleh memiliki bilangan bulat yang positif.
- Bilangan kuantum azimuth (l) dalam konfigurasi elektron menggambarkan bentuk orbitalnya. Dimana l boleh memiliki bilangan bulat mulai dari 0 sampai n-1.
- Bilangan kuantum magnetik (m) dalam konfigurasi elektron menggambarkan orientasi orbital. Dimana nilai m boleh memiliki bilangan mulai dari -1 sampai +1.
- Bilangan kuantum spin (s) dalam konfigurasi elektron menggambarkan arah dari spin elektron orbital. Dimana nilai s boleh memiliki bilangan +1/2 atau -1/2.
Untuk menentukan konfigurasi elektron harus memperhatikan beberapa aturan dibawah ini :
- Asas Aufbau, dimana elektron harus berada dalam orbital dengan tingkat energi paling redah dahulu, mulai dari 1s, 2s, 2p, dan sebagainya menurut urutan sub kulit. Berikut gambarnya :

- Asas larangan Pauli, dimana dua elektron tidak terdapat dalam satu atom yang mempunyai empat bilangan kuantun sama. Maksimal setiap orbital dapat terisi dengan 2 elektron yang spinnya berlawanan.
- Kaidah Hund, apabila orbitalnya memiliki tingkat energi sama, maka konfigurasi elektronnya menggunakan energi paling rendah. Dengan begitu jumlah elektron yang tidak memiliki pasangan akan mempunyai spin pararel terbanyak.

Dalam konfigurasi elektron terdapat anomali, dimana sub kulit d yang terdensi dapat diisi sampai penuh. Misalnya Cr (Z = 24) : [Ar] 4s1 3d5 yang lebih stabil daripada [Ar] 4s2 3d4 , serta Cu (Z = 29) : [Ar] 4s1 3d10 yang lebih stabil daripada [Ar] 4s2 3d9. Konfigurasi elektron pada Ion Monoatomik K+, S2-, Na+, Br- dan Ca+ ditentukan dari aton netral. Untuk kation pada ion monoatomik Ac+ dengan muatan x+ akan melepas/mengurangi x elektron pada kulit terluar dalam atom netral A. Kemudian untuk anion pada ion monoatomik By- dengan muatan y- akan menangkap/menambah y elekron dari orbital energi yang paling rendah sebelum dipenuhi elektron.
Demikianlah penjelasan mengenai konfigurasi elektron lengkap. Semoga artikel ini dapat menambah ilmu anda. Terima kasih.
 Teknobae.com Berita Teknologi, Review Gadget, Laptop, Komputer, Smartphone, Handphone
Teknobae.com Berita Teknologi, Review Gadget, Laptop, Komputer, Smartphone, Handphone


