Pengertian Laju Reaksi, Faktor, Rumus, Orde dan Contoh Soal Laju Reaksi – Ilmu pembelajaran mengenai Kimia pada dasarnya dapat kita terapkan dalam kehidupan sehari hari. Kimia tersebut akan memberikan gambaran sebuah kehidupan dengan keberagamannya dan tampak lebih detail. Maka dari itu banyak para pengajar yang menerapkan konsep kimia yang hadir dengan contoh contoh sederhana dalam kehidupan sehari haru. Sebenarnya tanpa kita sadari penggunaan konsep kimia telah dilakukan sehari hari, baik disengaja atau tidak disengaja. Misalnya saja laju reaksi yang sedang kita bahas saat ini.
Apa pengertian laju reaksi? Apa saja faktor faktor laju reaksi? Bagaimana rumus laju reaksi? Apa saja orde laju reaksi? Bagaimana cara menyelesaikan contoh soal laju reaksi? Materi laju reaksi ini tentunya telah kita pelajari ketika di bangku sekolah. Materi tersebut cukup mudah untuk dipahami.

Dalam kimia terdapat materi pembahasan tentang laju reaksi yang diartikan sebagai perubahan jumlah besar pereaksi maupun hasil reaksi setiap satuan waktu. Perubahan tersebut sering disebut sebagai perubahan molaritas (konsentrasi molar). Maka dari itu perubahan hasil reaksi (konsentrasi akhir) pada laju reaksi terjadi pada pereaksi (konsentrasi awal) setiap satuan waktu. Pada kesempatan kali ini saya akan menjelaskan tentang pengertian laju reaksi, faktor laju reaksi, rumus laju reaksi, orde laju reaksi dan contoh soal laju reaksi. Untuk lebih jelasnya dapat anda simak di bawah ini.
Baca juga : Tekanan Osmosis (Pengertian, Rumus, Proses Terjadi, dan Contohnya)
Pengertian Laju Reaksi, Faktor, Rumus, Orde dan Contoh Soal Laju Reaksi
Sebenarnya dalam kehidupan sehari hari, kita sering menjumpai hal hal yang bernuansa dengan laju reaksi. Dalam pelajaran pun laju reaksi baik itu pengertian, rumus laju reaksi, faktor yang mempengaruhi, serta contoh soal laju reaksi telah dijabarkan dalam pelajaran kimia di sekolah. Menurut saya pribadi materi laju reaksi tidaklah terlalu kompleks.
Laju reaksi sendri bukan hanya sekedar transformasi dari zat A menjadi zat yang baru saja. terdapat berbagai faktor, orde dan rumus laju reaksi. Untuk itu dalam pembahasan kali ini, saya akan membaginya menjadi beberapa sub menu seperti pengertian laju reaksi, faktor laju reaksi, rumus laju reaksi, orde laju reaksi dan contoh soal laju reaksi. Adapun penjelasan selengkapnya bisa anda simak dalam materi di bawah.
Pengertian Laju Reaksi
Definisi laju reaksi adalah laju pertambahan hasil reaksi (produk) maupun laju penurunan pereaksi (reaktan). Materi laju reaksi tersebut berisi gambaran mengenai cepat lambatnya sebuah reaksi kimia. Adapun makna dari reaksi kimia yakni proses sebuah zat pereaksi yang diubah menjadi sebuah produk (zat baru). Berlangsungnya beberapa reaksi kimia dapat terjadi dengan cepat. Misalnya saja reaksi Natrium yang masuk ke dalam air hingga menyebabkan reaksinya sangat cepat dan hebat. Selain itu ada juga kembang api dan petasan yang dinyalakan, maka akan bereaksi dengan cepat. Kemudian bensin akan lebih cepat terbakar jika dibandingkan dengan minyak tanah.
Berdasarkan pengertian laju reaksi di atas sebenarnya reaksi ini juga dapat terjadi dengan laju yang lambat. Seperti halnya yang terjadi pada sebuah besi yang berkarat. Besi tersebut dapat berkarat dengan waktu yang cukup lama, maka dari itu laju reaksinya terjadi secara lambat. Untuk itu laju reaksi dapat digunakan untuk menyatakan cepat lambat terjadinya proses reaksi kimia. Materi laju reaksi ini memiliki satuan konsentrasi setiap waktu yang berupa Molaritas. Maka dari itu materi ini memiliki satuan konsentrasi yakni Molaritas.
Molaritas sendiri digunakan untuk menunjukkan banyaknya mol zat dalam satu liter larutan. Molaritas dilambangkan dengan huruf “M”. Adapun rumus molaritas dalam laju reaksi yaitu:
M = n/V
Keterangan:
M = Molaritas
n = Jumlah mol ( satuan mmol atau mol)
V = Volume (satuan mL atau L)
Faktor Laju Reaksi
Selanjutanya saya akan membahas tentang faktor pada laju reaksi. Laju reaksi dipengaruhi oleh beberapa faktor didalamnya. Adapun faktor faktornya yaitu meliputi:
Konsentrasi Reaktan
Faktor laju reaksi yang pertama ialah konsentrasi reaktan. Konsentrasi reaktan yang semakin tinggi akan menyebabkan jumlah partikel reaktannya semakin banyak yang bertumbukan. Maka dari itu tumbukan tersebut akan terjadi dengan frekuensi yang semakin tinggi dan lebih meningkatkan lajunya. Misalnya di udara yang terjadi reaksi korosi pada besi. Besi tersebut akan mengalami laju reaksi korosi yang lebih tinggi jika ditempatkan dalam udara yang tinggi kelembapannya. Untuk itu reaktan H2O akan memiliki konsentrasi lebih tinggi.
Suhu
Faktor pada laju reaksi selanjutnya ialah suhu. Jika sebuah reaksi memiliki suhu yang naik, maka gerakan partikelnya akan semakin aktif. Dengan begitu akan sering terjadi tumbukan karena semakin besarnya laju reaksi. Namun jika suhu turun, maka gerakan partikel tidak akan aktif sehingga semakin kecil laju reaksinya.
Tekanan
Faktor pada laju reaksi selanjutnya ialah tekanan. Pada dasarnya reaksi banyak yang menghubungkannya dengan pereaksi berwujud gas. Pereaksi tersebut akan memiliki kelajuan yang dipengaruhi oleh tekanan. Tekanan yang ditambahkan akan membuat konsentrasi semakin besar dan volume semakin kecil. Maka dari itu laju reaksinya akan semakin besar.
Keberadaan Katalis
Faktor laju reaksi selanjutnya ialah keberadaan katalis. Katalis adalah sebuah zat yang membuat laju reaksi kimia semakin cepat dalam suhu tertentu, tanpa menggunakan atau merubah reaksi itu sendiri. Katalis tersebut tidak digunakan sebagai produk ataupun pereaksi, meskipun sebenarnya masih berperan serta dalam reaksi. Katalis ini cenderung membuat reaksi dapat berlangsung karena perubahan pereaksi dengan suhu yang rendah atau cenderung membuat berlangsungnya reaksi semakin cepat. Katalis menyajikan energi aktivasi rendah dengan jalur pilihan. Kebutuhan energi dalam reaksi tersebut akan dikurangi dengan menggunakan katalis.
Luas Permukaan Sentuh
Faktor pada laju reaksi selanjutnya ialah luas permukaan sentuh. Dalam laju reaksi terdapat peran luas permukaan sentuh yang cukup penting, karena antar partikel yang luas permukaan sentuhnya semakin besar akan menyebabkan banyak tumbukan sehingga membuat semakin cepat laju reaksinya. Namun jika luas permukaan sentuhnya semakin kecil, maka antar partikel akan mengalami tumbukan yang semakin kecil pula sehingga membuat semakin kecil laju reaksinya. Selain itu juga dipengaruhi oleh kepingan yang bereaksi. Jika kepingannya semakin halus, maka akan membutuhkan waktu yang semakin cepat pula dalam melakukan reaksi. Sedangkan jika kepingan tersebut semakin kasar, maka membutuhkan waktu yang semakin lama dalam melakukan reaksi.
Baca juga : Alat Alat Laboratorium Beserta Fungsi Dan Gambarnya
Rumus Laju Reaksi
Setelah menjelaskan tentang pengertian laju reaksi dan faktor laju reaksi di atas. Selanjutnya saya akan membahas tentang rumus pada laju reaksi. Sebuah reaksi mengandung reaktan A dan reaktan B yang akan membentuk produk C dan D. Rumus laju reaksi akan saya jelaskan melalui contoh persamaan berikut ini. Reaktan A dan B akan memiliki jumlah molekul yang semakin lama berkurang, sedangkan produk C dan D akan memiliki jumlah molekul yang semakin bertambah. Jika dinyatakan dalam bentuk rumus persamaan laju reaksi, maka akan menjadi seperti di bawah ini:

Dalam rumus laju reaksi di atas terdapat reaktan A dan B yang mengalami perubahan konsentrasi, maka dari itu diberikan tanda negatif sehingga nilainya akan menjadi positif. Untuk itu laju reaksi adalah besaran yang harus selalu bernilai positif. Laju reaksi memiliki satuan yaitu mol L⁻¹ s⁻¹ atau M s⁻¹.
Persamaan Laju Reaksi
Selain rumus pada laju reaksi di atas, saya juga akan menjelaskan tentang persamaan laju reaksi. Dalam sebuah reaksi kimia terdapat persamaan seperti berikut ini:
ɑA + bB → pP + qQ
Kemudian laju reaksi memiliki hubungan dengan Molaritas yang dinyatakan dalam bentuk persamaan di bawah ini:
v = k[A]ⁿ[B]ᵐ
Keterangan :
v = Laju reaksi
k = Konstanta laju reaksi
n = Orde reaksi zat B
m = Orde reaksi zat A
Orde Laju Reaksi
Selanjutnya saya akan menjelaskan tentang orde pada laju reaksi. Laju reaksi tersebut memiliki pengaruh konsentrasi reaktan yang besarnya dapat dinyatakan dengan menggunakan orde reaksi. Adapun beberapa orde dalam laju reaksi yaitu diantaranya:
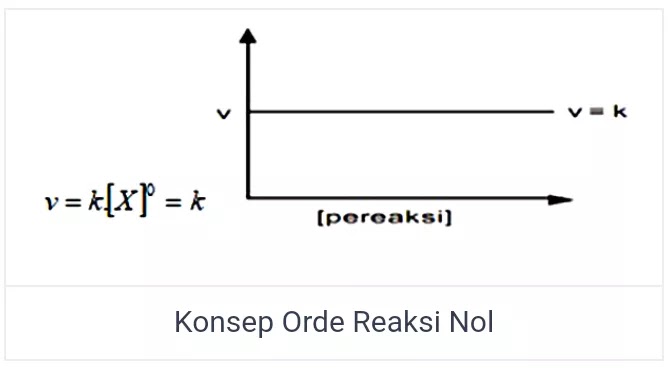
Orde Reaksi Nol
Orde laju reaksi yang pertama ialah orde reaksi nol. Salah satu reaktan yang memiliki reaksi dengan orde nol, apabila laju reaksi tidak dipengaruhi oleh perubahan konsentrasi reaksinya. Maka dari itu laju reaksi tidak akan terpengaruh terhadap perubahan konsentrasi reaktan meskipun didalamnya berjumlah tertentu. Laju reaksi memiliki besar yang hanya dipengaruhi oleh besar konstanta laju reaksinya (k).
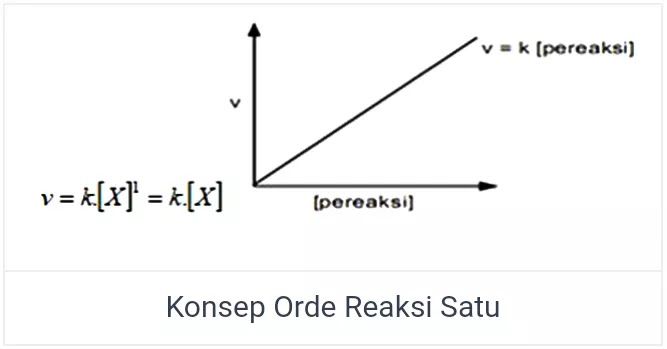
Orde Reaksi Satu
Orde pada laju reaksi selanjutnya ialah orde reaksi satu. Salah satu reaktan yang memiliki reaksi dengan orde satu, apabila laju reaksi dengan konsentrasi reaktannya saling berbanding lurus. Apabila dilipat tigakan pada konsentrasi reaktan maka besar laju reaksi akan menjadi lebih besar 3 kali atau menjadi 3¹.
Baca juga : Pengertian Reaksi Redoks, Penyetaraan dan Contohnya
Orde Reksi Dua
Orde laju reaksi selanjutnya ialah orde reaksi dua. Salah satu reaktan yang memilki reaksi dengan orde dua, apabila laju reaksi memiliki pangkat dua dari konsentrasi reaktan tersebut. Maka apabila dilipat tigakan konsentrasi reaktannya, maka besar laju reaksinya menjadi lebih besar 9 kali atau menjadi 3².

Contoh Soal Laju Reaksi
Diketahui sebuah reaksi senyawa dengan persamaan 2N2O5 → 4NO2 + O2. Tentukan rumus laju reaksinya?
Jawab.

Sekian penjelasan mengenai pengertian laju reaksi, faktor laju reaksi, rumus laju reaksi, orde laju reaksi dan contoh soal laju reaksi. Laju reaksi ialah laju pertambahan hasil reaksi (produk) maupun laju penurunan pereaksi (reaktan). Semoga artikel tentang materi laju reaksi lengkap ini dapat menambah ilmu anda dan selamat belajar.
 Teknobae.com Berita Teknologi, Review Gadget, Laptop, Komputer, Smartphone, Handphone
Teknobae.com Berita Teknologi, Review Gadget, Laptop, Komputer, Smartphone, Handphone


