Materi Termokimia – Dalam ilmu Kimia terdapat materi tentang termokimia. Apa pengertian termokimia itu? Bagaimana persamaan termokimia? Bagaimana reaksi termokimia? Termokimia sendiri dapat diartikan sebagai perubahan panas atau kalor pada sebuah zat yang berhubungam dengan proses fisika dan kimia. Termokimia tersebut termasuk dalam materi termodinamika yang berisi pembahasan energi yang dirubah menjadi kalor reaksi dari manifestasi reaksi kimia. Gerakan beberapa partikel yang menyusun zat tersebut selalu konstan sehingga energi kinetik dapat dimiliki oleh zat itu. Dalam sebuah objek rata rata memiliki energi kinetik yang berbanding lurus dengan 0K (temperature absolut).
Gerakan pada atom molekul yang menyusun objek terjadi dengan cepat apabila kondisi objek tersebut panas. Maka dari itu besar energi kinetiknya cukup banyak. Selain itu dalam sebuah zat juga mencakup energi potensial dari gaya tolak menolak dan tarik menarik diantara berbagai partikel yang menyusun zat tersebut. Energi yang terbentuk ini dapat berupa energi kalor. Hal itu tentunya berkaitan dengan materi termokimia yang membahas tentang pengertian termokimia, persamaan termokimia dan reaksi termokimia.

Dalam termokimia terdapat peran serta kalor di dalamnya. Apa itu kalor? Kalor ialah salah satu energi yang terbentuk dalam pertukaran lingkungan dengan sistemnya. Kemudian adapula kalor reaksi yaitu energi yang dirubah menjadi bentuk kalor melalui reaksi kimia. Kita dapat mendeteksi adanya kalor secara umum dalam sebuah benda menggunakan alat pengukur suhu. Jika dalam suatu benda terdapat suhu tinggi maka kalornya juga akan lebih besar, begitu pula sebaliknya. Pada kesempatan kali ini saya akan menjelaskan tentang materi termokimia yang berisi pengertian termokimia, persamaan termokimia, dan reaksi termokimia. Untuk lebih jelasnya dapat anda simak di bawah ini.
Materi Termokimia: Pengertian, Persamaan dan Reaksinya
Seperti yang telah saya jelaskan di atas bahwa dalam reaksi kimia terdapat alat pengukur kalor reaksi bernama kalorimeter. Dalam penggunaan kalorimeter terdapat teknik dua zat yang dicampur dalam sebuah wadah. Alat ini secara umum digunakan untuk mengetahui kalor jenis sebuah zat. Kalorimeter tersebut pada dasarnya dapat dibagi menjadi dua macam yaitu kalorimeter tekanan tetap dan kalorimeter volume tetap.
Dalam materi termokimia ini terdapat pembahasan mengenai pengertian termokimia, persamaan termokimia dan reaksi termokimia. Termokimia dapat didefinisikan sebagai hukum pertama termodinamika yang diterapkan dalam pertistiwa kimia beserta reaksi kimia dan kalor yang dibahas di dalamnya. Selain itu termokimia juga dapat diartikan sebagai ilmu kimia yang membahas tentang perubahan atau dinamika reaksi kimia terkait termal atau panas. Dalam kehidupan sehari hari terdapat penerapan ilmu ini dalam tubuh kita. Hal ini dikarenakan tubuh kita mengandung reaksi kimia yang energi energinya diproduksi didalamnya.
Baca juga : Pengertian Laju Reaksi, Faktor, Rumus, Orde dan Contoh Soal Laju Reaksi
Pengertian Termokimia
Termokimia adalah ilmu yang membahas tentang hubungan energi kimia dengan energi panas. Energi kimia sendiri dapat diartikan sebagai kandungan energi yang terdapat dalam sebuah senyawa atau unsur. Dalam sebuah zat tersebut terdapat kandungan energi kimia yang berupa energi potensial seperti entalpi atau panas dalam. Simbol entalpi sendiri ialah huruf H. Dalam sebuah reaksi sendiri terdapat selisih anara entalpi reaktan dengan entalpi hasil yang dinamakan perubahan entalpi reaksi dengan lambang ΔH.
Kemudian dalam materi termokimia juga terdapat pembahasan mengenai perubahan panas atau kalor suatu zat yang disertai dengan reaksi fisika dan kimianya. Operasional termokimia sendiri berhubunan dengan penafsiran dan pengukuran perubahan kalor yang disertai dengan pembentukan larutan, reaksi kimia, dan perubahan kondisi. Dalam termokimia tersebut terdapat pokok pembahasan mengenai hasil jumlah kalor dalam pereaksi tertentu dan cara mengukur kalor reaksinya.
Persamaan Termokimia dan Entalpi
Setelah membahas tentang pengertian termokimia, selanjutnya saya akan menjelaskan tentang persamaan termokimia dan entalpi. Persamaan termokimia ialah persamaan reaksi yang berhubungan dengan perubahan dalam entalpi (DH). Dalam persamaan ini terdapat penulisan nilai DH berdasarkan stoikiometri reaksi. Dengan kata lain dalam reaksi kimia terdapat hubungan jumlah mol zat yang besarnya sama dengan koefisien reaksinya. Selain itu juga harus ditulis produk reaktan maupun fase reaktannya. Penulisan persamaan dalam termokimia harus memperhatikan beberapa hal seperti di bawah ini:
- Koefisien reaksi yang menyatakan keterkaitan jumlah mol zat pada reaksinya.
- Saat pembalikan persamaan reaksinya dari letak reaktan yang diubah menjadi produknya akan membuat persamaan DH dengan nilai tetap, namun hanya berlawanan saja tandanya.
- Apabila kedua sisi persamaan termokimia digandakan dengan faktor y, maka faktor y ini harus dikali juga dengan nilai DH.
- Saat persamaan reaksi termokimia ditulis, maka harus ditulis pula fase produk dan fase reaktannya.
Inilah beberapa hal yang perlu diperhatikan dalam menulis persamaan termokimia dalam materi termokimia tersebut. Persamaan reaksi kimia sendiri juga dapat didefinisikan sebagai persamaan reaksi setara yang berhubungan dengan entalpi reaksi (kalor reaksi) serta menyatakan keterlibatan antara energi dengan massanya. Misalnya
Baca juga : Pengertian Reaksi Redoks, Penyetaraan dan Contohnya
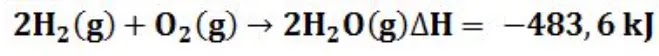
Dalam hal ini tedapat energi dalam (E) yang dijumlahkan dengan hasil kali Volume (V) dan tekanan (P) sistem di fungsi kondisi yang bernama Entalpi (H).
Setelah terjadi perubahan entalpi (ΔH) dalam tekanan konstan akan berlangsung entalpi reaksi (ΔHrx) dengan persamaan nilai pada kalor reaksinya (q). Hal ini diwujudkan dalam bentuk rumus termokimia seperti di bawah ini;
H = E + PV [dimana P Konstan]ΔH = ΔE + PΔV [dimana P Konstan]ΔH = (qp + w) + PΔV [dimana P Konstan]ΔH = (qp + (-PΔV)) + PΔV [dimana P Konstan]ΔH = qp [PKonstan]
Dalam materi termokimia juga terdapat pengertian entalpi reaksi (ΔHrx) yaitu fungsi keadaan yang nilainya sesuai dengan H awal dan H akhir. Awal dan Akhir dalam reaksi kimia ini dapat dinamakan dengan Reaktan dan Produk. Untuk itulah jumlah H produk dapat kurang dari atau lebih dari H reaktan sehingga nilai ΔHrx dalam sistem reaksi dapat ditandai sesuai dengan pelepasan dan penyerapan kalornya. Apabila dinyatakan dalam bentuk persamaan termokimia, maka akan menjadi seperti di bawah ini:
ΔHrx = H akhir – H awal = H produk – H reaktan
Reaksi Termokimia
Setelah menjelasakan tentang pengertian termokimia dan persamaan termokimia di atas, selanjutnya saya akan membahas tentang reaksi termokimia. Termokimia pada dasarnya memiliki bentuk reaksi yang terdiri dari reaksi endoterm dan reaksi eksoterm. Berikut penjelasan selengkapnya:
Reaksi Eksoterm
Reaksi eksoterm merupakan reaksi dalam materi termokimia yang dapat ditulis dalam bentuk tanda negatif karena melepaskan kalor atau panas. Dalam reaksi ini terdapat gambaran perubahan entalpi yang dapat dinyatakan dalam bentuk persamaan seperti di bawah ini:
P + Q → R + xKkal
Keterangan:
P dan Q = zat awal
R = zat hasil reaksi
x = besar panas pada reaksi
Reaksi eksoterm juga dapat dinyatakan dalam bentuk hukum kekekalan energi seperti dibawah ini:
Isi panas (P + Q) = isi panas R + xKkal
H(p + Q) = H(R) + xKkal
H(R) – H(P + Q) = -xKkal
ΔH = -Kkal
Reaksi Endoterm
Materi termokimia selanjutnya yang akan saya jelaskan ialah reaksi termokimia jenis endoterm. Terjadinya reaksi ini berlangsung ketika kalor atau panas diserap, maka nilai reaksinya akan positif pada perubahan entalpinya. Reaksi endoterm memiliki rumus perubahan entalpi seperti di bawah ini:
R → P + Q – x Kkal
H(P + Q) – H(R) =x Kkal
ΔH = xKkal
Sekian penjelasan mengenai materi termokimia yang berisi pengertian termokimia, persamaan termokimia, dan reaksi termokimia. Termokimia ialah ilmu kimia yang membahas tentang perubahan atau dinamika reaksi kimia terkait termal atau panas. Semoga artikel ini dapat bermanfaat dan terima kasih telah berkunjung di blog ini.
 Teknobae.com Berita Teknologi, Review Gadget, Laptop, Komputer, Smartphone, Handphone
Teknobae.com Berita Teknologi, Review Gadget, Laptop, Komputer, Smartphone, Handphone


